MedTechConsulting
医疗器械注册
文件开发
测试组织
自2011年以来,MedTechConsulting(医疗设备咨询)有限责任公司一直提供俄罗斯各种医疗器械注册的咨询和方法服务
风险等级1, 2a, 2b, 3的医疗器械
用于体外诊断的医疗器械
大型医疗器械,如CT、MRI、X光等
电动和非电动医疗器械
一次性和可重复使用的医疗器械
无菌和有菌医疗器械
可植入和非可植入医疗器械
我们赢得了众多客户的信任
我们公司成功的基础在于坚持诚实透明的业务方式、高质量的工作、专业性、以客户为中心、适应不断变化的立法环境,以及最重要的,人际关系的价值。
现代医疗器械和设备的制造商,对于各种目的和复杂性的设备,都渴望尽快且成本效益地进入俄罗斯市场。我们公司通过提供必要的咨询和全面支持,协助制造商实现这些目标,包括注册医疗器械和体外诊断产品的整个过程。
年经验
%
成功合同
客户
“MedTechConsulting (医疗设备咨询)”致力于在工作的每个阶段实现高标准,我们获得注册证书的成功率、工作模式的高效率、公司的动态增长以及市场声誉都证明了这一点。
我们的
公司专业服务
医疗器械注册领域的专家知识与国内外大型外国和俄罗斯公司的国际工作经验。
咨询公司“MedTechConsulting (医疗设备咨询)”提供用于进行毒理学、技术和临床试验的咨询和方法服务,包括临床实验室测试,以及针对俄罗斯联邦医疗器械监督局 (Roszdravnadzor) 注册医疗器械的合规评估和必要法规文件的开发。公司提供专业协助,修改注册档案文件,包括在负面国家控制结论情况下进行所有必要的操作。公司的一个显著特点是其在注册个体体外诊断医疗器械,以及作为“系列”(分析系统的联合测试)一部分的设备注册方面的丰富经验,特别是分析仪、软件、试剂、消耗品和实验室设备。
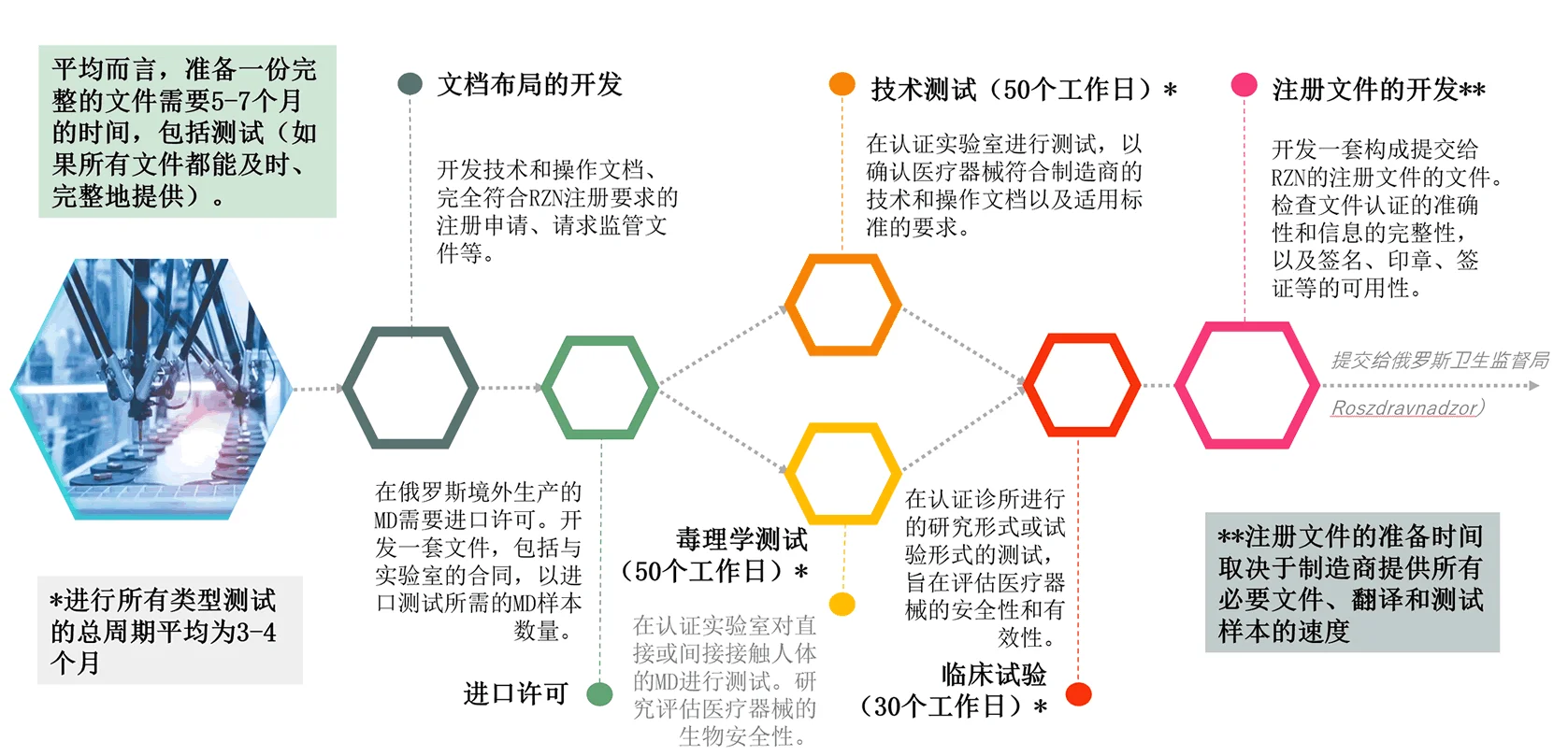
文件准备和请求
请求和分析必要文件,以及验证这些文件是否根据俄罗斯联邦法律的要求准备和公证
进口许可
组织获得进口测试样品许可,组织在俄罗斯联邦和国外(对于外国制造的医疗器械)的现场测试
技术文件开发
符合性评估,技术和操作文件的开发和编写,验证和更正制造商准备的文件。
测试组织
- 技术测试;
- 电磁兼容性测试;
- 毒理学测试;
- 临床试验,包括体外设备
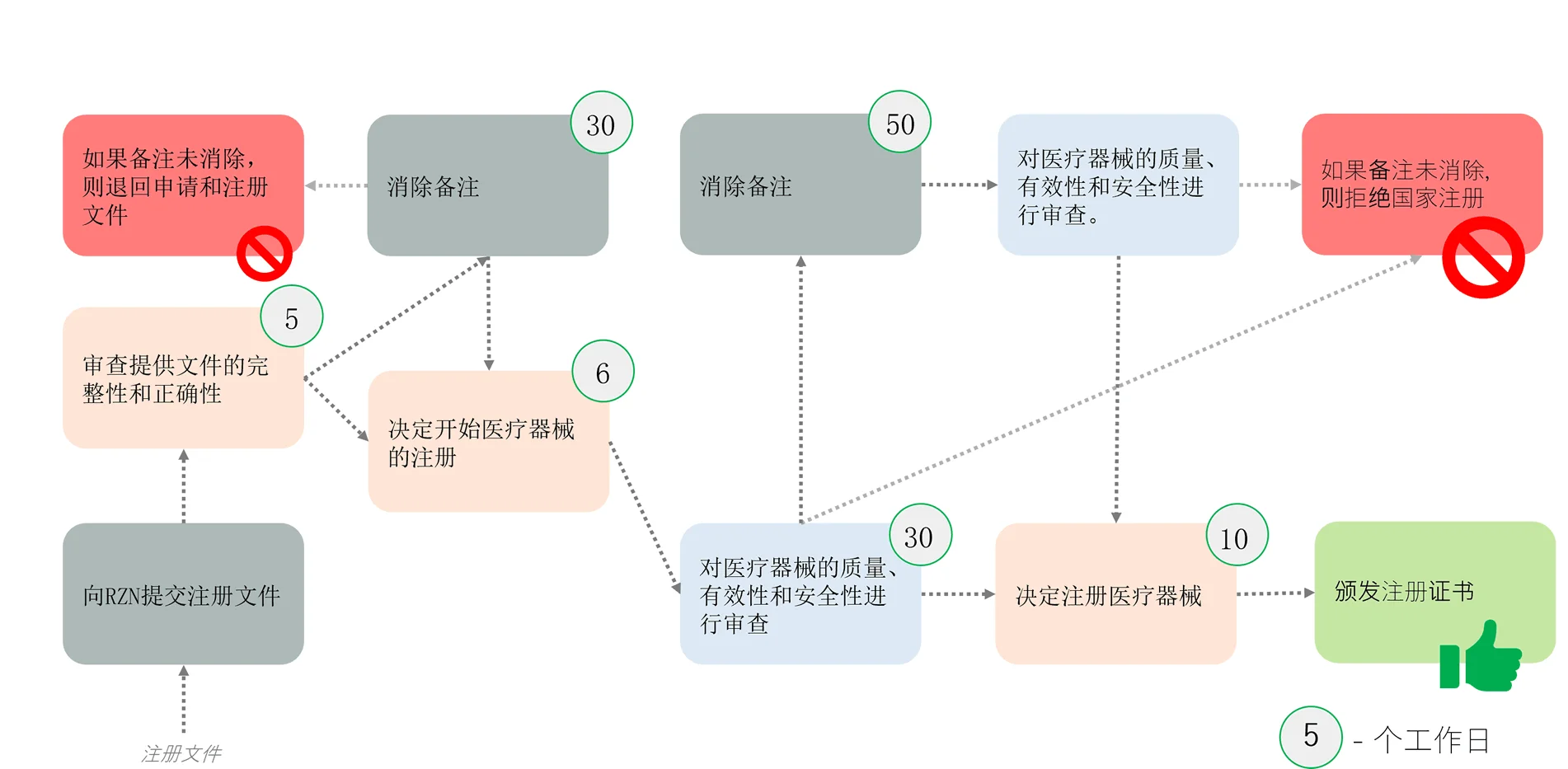
注册证书 (RC)
注册证书 (RC) 是一份文件,证明医疗器械符合既定要求,并且已在俄罗斯进行注册。
什么是注册,为什么需要注册医疗器械?
根据《俄罗斯联邦公民健康保护基本法》第38条第4款:
只有在俄罗斯联邦政府或其授权的联邦行政机关按照规定程序注册的医疗器械,才允许在俄罗斯联邦境内流通
医疗器械的注册是一项旨在只将有效、安全且高质量的产品推向市场的国家程序。
换句话说,医疗器械的注册是其进口、使用、销售以及在俄罗斯联邦境内生产的前提条件。
- 直至2025年12月31日,您可以选择医疗器械的注册类型,可以根据国家(内部规则)注册,也可以根据欧亚经济联盟(EAEU)的规则进行注册。
- 2025年12月31日之后,所有医疗器械必须根据欧亚经济联盟(EAEU)的统一规则进行注册(除非国家立法的有效性得到延长,如之前所延长)。
在俄罗斯联邦境内,医疗器械的注册由俄罗斯联邦卫生监督服务(RosZdravNadzor / RZN)负责执行。
在俄罗斯注册医疗器械有几种选择:

欧亚经济联盟的立法
使医疗器械可以在所有欧亚经济联盟(EAEU)国家的领土上流通(在所有您选择的EAEU成员国对检查结论给出正面决定并予以认可的情况下)。
目前,EAEU包括五个国家:亚美尼亚共和国、白俄罗斯共和国、哈萨克斯坦共和国、吉尔吉斯共和国、俄罗斯联邦。
以下是EAEU注册医疗器械的主要法律法规:
- 2014年12月23日关于欧亚经济联盟框架内医疗器械(医疗产品和医疗设备)流通的共同原则和规则的协议
- 欧亚经济委员会(EEC)决定46号《关于注册和审查医疗器械的安全性、质量和有效性的规则》

俄罗斯联邦的国家立法
使医疗器械仅能在俄罗斯联邦境内流通。
以下是俄罗斯注册医疗器械的主要国家法律法规:
- 《关于保护俄罗斯联邦公民健康基本原则的联邦法律》第323-FZ号
- 俄罗斯联邦政府令第1416号《关于批准医疗器械国家注册规则的决定》
- 俄罗斯联邦政府令第552号《关于批准因引入针对俄罗斯联邦的经济性限制措施而存在缺陷或缺陷风险的医疗器械流通特殊性,包括国家注册特殊性的决定》
- 俄罗斯联邦政府令第430号《关于医疗器械流通特殊性的决定,包括一系列(批次)医疗器械的国家注册》
质量管理体系的实施和生产检查
- 俄罗斯联邦政府2022年2月9日令第136号《关于批准根据医疗器械使用的潜在风险实施、维护和评估质量管理体系要求的决定》
- 俄罗斯联邦政府2022年2月9日令第135号《关于批准组织和进行医疗器械生产合规性检查的规则,以符合根据医疗器械使用的潜在风险实施、维护和评估质量管理体系的要求》
自2024年1月1日起,按照ISO 13485标准实施质量管理体系:
| 医疗器械的风险等级 | 质量管理体系(QMS) |
|---|---|
| 1 | 自愿 |
| 2a(非无菌) | 自愿 |
| 2a(无菌) | 必须 |
| 2b | 必须 |
| 3 | 必须 |
作为2024年1月1日起提交给俄罗斯卫生监督局(Roszdravnadzor)进行国家注册的注册文件的一部分,必须提交由RZN的俄罗斯专家执行的符合ISO 13485标准的生产初次检查报告。
请求医疗器械认证和注册咨询
完成我们的简短问卷,即可享受我们咨询服务的10%折扣。